Кислоти — це складні речовини, які складаються з атомів Гідрогену, що можуть заміщатися атомами металічних елементів, та кислотних залишків.
Кислоти - це молекулярні сполуки.
*Кислоти — речовини, розчини яких дисоціюють з утворенням йонів Гідрогену Н+ і мають pH < 7,0.
Кислоти - це молекулярні сполуки.
*Кислоти — речовини, розчини яких дисоціюють з утворенням йонів Гідрогену Н+ і мають pH < 7,0.
Згідно із теорією кислот та основ Арреніуса, кислотам можна дати інше визначення, а саме: кислоти — це складні речовини, які у водних розчинах піддаються електролітичній дисоціації з утворенням йонів Гідрогену.
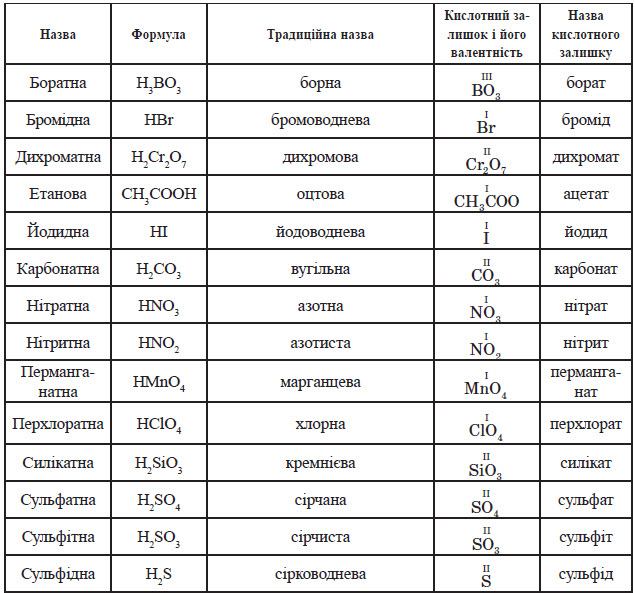
Номенклатура.
Назви кислот походять від назви кислотоутворюючого елементу. Якщо кислотоутворюючий елемент оксигеновмісних кислот проявляє найвищу можливу валентність, назва кислоти має закінчення -атна, наприклад: HNO3 — нітратна кислота (азотна)
Якщо кислотоутворюючий елемент оксигеновмісних кислот проявляє нижчу позитивну валентність, назва кислоти має закінчення -итна, наприклад: HNO2 — нітритна кислота (азотиста)
Назви безкисневих кислот мають закінчення -идна або -ідна. Наприклад: HCl — хлоридна кислота (хлороводнева, або соляна)
Найважливіші кислоти

Класифікація кислот
За різними ознаками кислоти поділяють на різні групи. За вмістом атомів Оксигену кислоти поділяють на оксигеновмісні та безоксигенові.
До оксигеновмісних кислот належать сульфатна H2SO4, нітратна HNO3 та ін. Оксигеновмісні кислоти є гідратами кислотних оксидів, тобто продуктами приєднання молекули води до молекули оксиду неметалічного елемента.
До безоксигенових кислот належать розчини деяких газів у воді. Наприклад, хлоридна кислота —це розчин газуватого хлороводню HCl у воді, фторидна — розчин фтороводню HF, сульфідна — розчин сірководню H2S тощо.
За числом атомів Гідрогену, здатних заміщатися на атоми металічного елемента (за основні стю кислоти), кислоти поділяють на одноосновні (HCl, HNO3), двохосновні (H2S, H2SO4), трьохосновні (H3PO4) тощо.
За силою кислот, тобто за здатністю дисоціюватися на йони, кислоти поділяють на сильні, кислоти середньої сили та слабкі.
ФІЗИЧНІ ВЛАСТИВОСТІ.
ТЕХНІКИ БЕЗПЕКИ
Дія кислоти на покриви ВІДЕО ДОСЛІД
Розведення кислоти водою ДОСЛІД
ДОБУВАННЯ
1) КИСЛОТНИЙ ОКСИД + ВОДА = КИСЛОТА
ФІЗИЧНІ ВЛАСТИВОСТІ.
Більшість кислот —
рідини, наприклад нітратна HNO3 і сульфатна Н2SO4
кислоти.
Деякі кислоти — тверді речовини, наприклад фосфатна Н3РО4
і боратна Н3ВО3 кислоти.
Більшість кислот добре розчинні у воді. Виняток — силікатна кислота H2SiO3,
яка практично нерозчинна.
Водні розчини кислот
відзначаються кислим смаком, руйнують рослинні і тваринні тканини.ТЕХНІКИ БЕЗПЕКИ
Дія кислоти на покриви ВІДЕО ДОСЛІД
Розведення кислоти водою ДОСЛІД
ДОБУВАННЯ
1) КИСЛОТНИЙ ОКСИД + ВОДА = КИСЛОТА

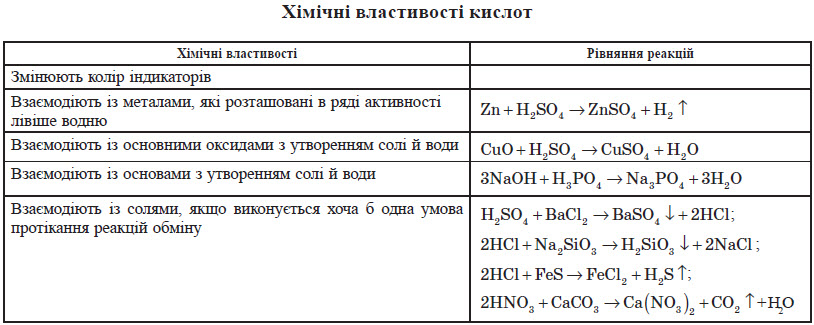
ХІМІЧНІ ВЛАСТИВОСТІ:
2. Кислоти реагують з металами , які в ряду напруг металів розміщені до Н
(усі крім Сu , Нg , Аg , Рt , Аu)
Zn + Н2SО4
= ZnSО4 + Н2
2Аl + 6НСl = 2АlСl3
+ 3Н2
3. Кислоти реагують з оксидами металів
СuО + Н2SО4 = СuSО4 + Н2О
Fе2О3 + 6НСl = 2FеСl3 + 3Н2О
4. Кислоти реагують з основами ( реакція нейтралізації)
NаОН + НСl = NаСl + Н2О
Сu(ОН)2 + Н2SО4 = СuSО4 + 2 Н2О
ВІДЕО ДОСЛІД
NаОН + НСl = NаСl + Н2О
Сu(ОН)2 + Н2SО4 = СuSО4 + 2 Н2О
ВІДЕО ДОСЛІД
5. Кислоти реагують з деякими солями , якщо в результаті реакції утворюється газ або осад
СаСО3 + 2НСl = СаСl2 + Н2О + СО2↑
АgNО3 + НСl = АgСl↓ + НNО3
ВІДЕО ДОСЛІД
СаСО3 + 2НСl = СаСl2 + Н2О + СО2↑
АgNО3 + НСl = АgСl↓ + НNО3
ВІДЕО ДОСЛІД
4*. Кислоти — сильні окисники
Концентрована сульфатна кислота а також нітратна кислота будь-якої концентрації є сильними окисниками. Вони взаємодіють з метелами, які в ряду напруг розміщені після Н, обвуглюють органічні речовини.
Реакція з металами:
Cu + 2Н2SО4 концентрована = CuSО4 + SО2 + Н2О
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Окиснення (обвуглювання) органічних речовин



Немає коментарів:
Дописати коментар